本篇目录:
- 1、请找高中化学奥赛初赛试题
- 2、2002年高中化学竞赛第十题(那个轮船用锌防腐的题目)真么解释?请详细说...
- 3、一道高中化学计算题
- 4、几道高中化学计算题,要过程
- 5、高中化学计算题(求大神帮助!!!)
- 6、3道高中化学计算题,要有详细过程
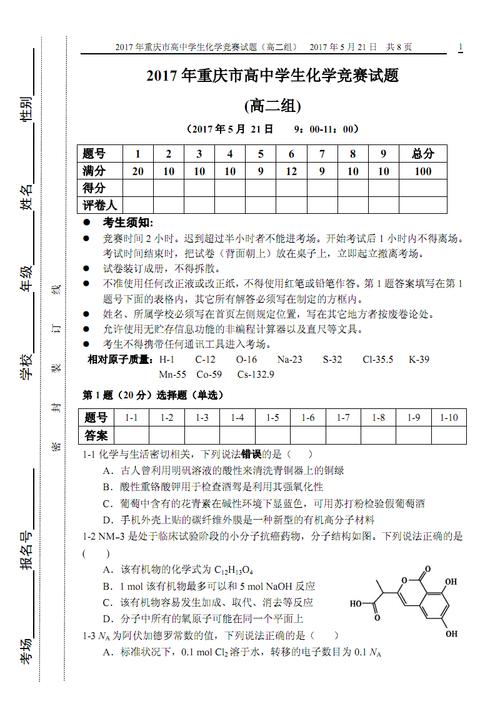
请找高中化学奥赛初赛试题
选择题(单选,本题包括12小题,每题3分,共36分)设N0为阿佛加德罗常数,下列对0.2 mol/L硫酸钠溶液的正确说法是( )。
A用纯碱熔融生成化合物B的同时放出无色气体C(标准状态下,密度为96 g/L)。若将C通入B的溶液中得到化合物D,D在空气里干燥转化至化合物E,E经加热又可得到A。

盐酸克仑特罗的化学名为α-〔(叔丁氨基)甲基〕一对氨基—3,5一二氯苯甲醇盐酸盐,化学式为C12H18Cl2N2OHCl。画出它的结构简式。在该结构简式上有*标出具有光学活性的原子,并比较它们的强弱。
第7题(11分)碳是元素周期表中最神奇的元素,它不仅是地球上所有生命的基础元素,还以独特的成键方式形成了丰富多彩的碳家族。
.02-X X 2X K=1/β2=10^-7=4X^3/(0.02-X),X=9*10^-3摩尔/升。

答案错了,4CuFeS2+15O2=4CuSO4+2Fe2O3+4SO2 至于“为什么不生成氧化铜”这个问题,在前面题目就有说明了:“生成物冷却后经溶解、除铁、结晶,得到CuSO45H2O,成本降低了许多。
2002年高中化学竞赛第十题(那个轮船用锌防腐的题目)真么解释?请详细说...
1、选用较重的锌块更合理,因其电流强度较小,理论上可以保证2年保护期限,而用较轻的锌块因其电流强度太大,不到2年就会消耗光。
2、.磷酸二氢铵是一种含有氮、磷两种营养元素的复合化肥,熟石灰常可用来中和土壤的酸性,但是这两种物质不宜混合使用,试写出有关反应的化学方程式 ,并说明原因。

3、年全国初中学生化学竞赛(第十二届天原杯)复赛试题选择题(本题12小题,每小题2分,共24分。每小题有1个或2个选项符合题意。若有两个答案的错1个不得分,漏选1个扣1分。
一道高中化学计算题
解析:生成氢气时的铁的质量可以求出,36/24=0.15mol,剩余的混合物样品为铁和氧化铁的总质量:88-0.15*56=4g,根据化学方程式可以列方程:设其中的铁粉xmol,氧化铁ymol。
所以混合气体中0.25mol一氧化碳燃烧放出的热量应为515KJ-445KJ=70KJ。所以每1mol一氧化碳燃烧放出的热量为280KJ。
g蒸气的体积是24L,那么他的分子量=2*24/24=62。设他的化学式为CxH3xOx。CxH3xOx=62,即31x =62,x=2,分子式C2H6O2。2g A与足量的金属钠作用,放出24L氢气,有2个羟基。
解:只有一种可能,就是氢氧化钾肯定过量,但加入了盐酸后,溶液恰好开始生成沉淀,也就是说过两部分的氢氧化钾被中和了。设与硫酸铝反应的氢氧化钾为 a mol;与盐酸反应的氢氧化钾为 b mol。
解题思路SiO2 +CaCO3 =CaSiO3 +CO2↑ CaCO3 =CaO +CO2↑【反应条件均为加热答案 V(CO2)=48L n(固 )=0、、我打不出加热符号.36L 5g 0.05mol 12L .余5g V(CO2)=4。
几道高中化学计算题,要过程
(1)写出反应的化学方程式。Na2CO3+2HCl=2NaCl+H2O+CO2(气体)NaHCO3+HCl=NaCl+H2O+CO2(气体)(2)计算混和物中碳酸钠的质量分数。
第一题,就是普通公式的运用。物质的量除以体积就是物质的量浓度。物质的量浓度乘以体积就是物质的量。0.5mol/L*0.05L后再除以0.25L。第二题,也是公式的运用。
g蒸气的体积是24L,那么他的分子量=2*24/24=62。设他的化学式为CxH3xOx。CxH3xOx=62,即31x =62,x=2,分子式C2H6O2。2g A与足量的金属钠作用,放出24L氢气,有2个羟基。
盐酸100毫升,浓度时2mol/L,则含有氯化氢共0.12摩尔,完全中和的情况下能中和氢氧化钠0.12摩尔。生成 0.12摩尔的氢氧化钠,需要的钠也是0.12摩尔,也就是76克。
mol丙烷有8mol氢原子可以取代。通过 CH4+CL2=CH3CI+HCI 可知1mol氯气分子能取代1mol氢,则8molH原子能供8molCI2取代。
高中化学计算题(求大神帮助!!!)
1、X 根据题得:160X+56X=84g-68g=16g X=0.01mol 所以氧化铁的质量=0.01mol*160g/mol=6g 氧化铁的质量为6克。
2、平均分子量是15*2=25,有机物中分子量低于25的只有甲烷,所以肯定有甲烷。 只需判断另一种烯烃就可以了。气体通过装有溴的试剂瓶时,试剂瓶的质量增加了4g,说明烯烃是4g。
3、C 4NO+3O2+2H2O=4HNO3 (这个反应可以由2NO+O2=2NO2以及3NO2+H2O=2NO+2HNO3各自乘以适当系数叠加而成)4体积NO消耗3体积O2最后剩余1体积O2,故1/8。
4、解根据题目,先写出反应式:CH4+ CO2==2CO+2H2, △H=288*2+280*2-890.3=243kJ/mol 2 243 1000/24 X 根据方程可得X=1000/24*243/2=5520kJ,是吸热反应。
5、解:(1)Fe2OFe3O4高温下与Al发生反应的化学方程式为:Fe2O3 + 2Al 高温 Al2O3 + 2Fe 3Fe3O4 + 8Al 高温 9Fe + 4Al2O3 由于恰好完全反应,生成物仅有氧化铝和铁组成。
3道高中化学计算题,要有详细过程
1、【解析】反应中氮元素由0价→-3价,碳元素由0价→+2 价,所以N2是氧化剂,C是还原剂,每生成1 mol AlN转移3 mol 电子,D项摩尔质量单位为g/mol。
2、化学计算题 要过程 解析 答案 多点的 1) 现有氯化钾和盐A组成的固体混合物,其中A是质量分数为69%。
3、这么三道题,应该分三次发!!要说明你是高中还是初中的了。
4、MnO2+4HCl(浓)=MnCl2+2H2O+Cl2↑ 可知,没有4molHCl参加反应,其中的2molHCl被氧化,因此每有2molHCl被氧化,就有1molMnO2被还原。
5、(3) 如混合物中含0.01moLCu,则其中Cu2O、CuO的物质的量分别为多少?(4) 如混合物中Cu的物质的量为X,求其中Cu2O、CuO的物质的量及X的取值范围。【点拨】本题为混合物的计算,若建立方程组求解,则解题过程较为繁琐。
到此,以上就是小编对于高中化学竞赛初赛题的问题就介绍到这了,希望介绍的几点解答对大家有用,有任何问题和不懂的,欢迎各位老师在评论区讨论,给我留言。

 微信扫一扫打赏
微信扫一扫打赏